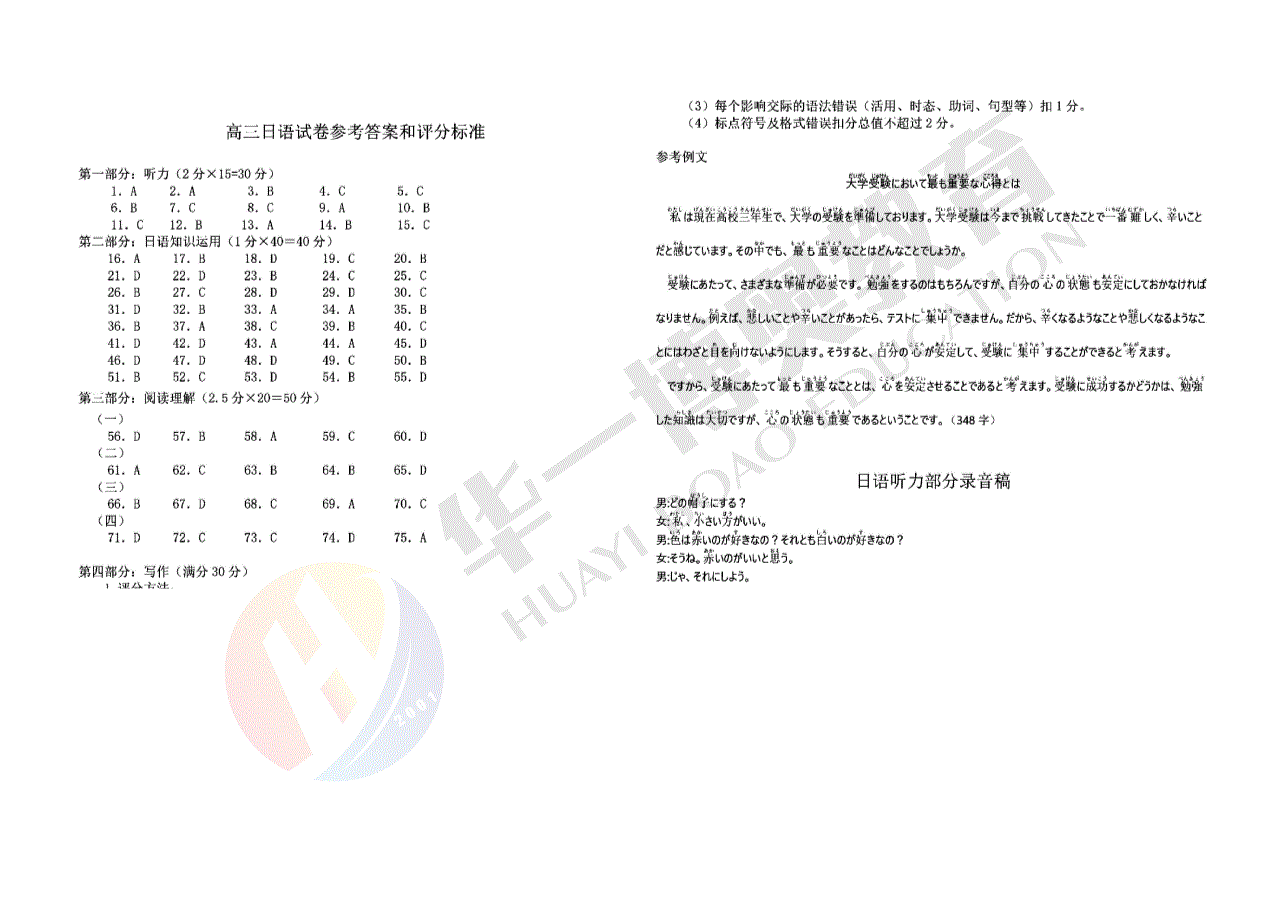
2023年湖北省八市高三(3月)联考化学参考答案1.C2.C3.C4.B5.D6.D7.B8.C9.B10.B11.A12.B13.D14.D15.D16(13分)(1)圆底烧瓶(1分),b(1分)。(2)防止温度过高,反应速率过快(2分)(答减速即可得分)(3)CrO3+2HCl=CrO2Cl2+H2O(2分)。(方程式不平不得分)(4)加入过量氯化钠可产生过量的氯化氢气体,使更多的CrO3参与反应。(2分)(5)将CrO2Cl2迅速冷凝便于收集,提高产率(或答减缓铬酰氯挥发)(2分)(6)B(1分)吸收未参与反应的HCl气体和逸出的铬酰氯蒸气,防止空气中的水蒸气进入装置。(2分)(两条各1分未答吸收铬酰氯蒸气不扣分)17(14分)(1)相同(2分)(2)19(2分)(3)(2分)(4)8(2分)(5)氨基(1分)碳氟键(1分)2HCl(1分)(6)①加成反应(1分)②形成的五元环较稳定(2分)(或答酰胺键比酯基稳定)18(14分)+2+(1)MnO2(或答二氧化锰)(2分)Mn2O3+2H=MnO2+Mn+H2O(2分)2+2+3+(2)将溶液中的Mn氧化为MnO2沉淀除去;将溶液中的Fe氧化为Fe。(2分,两条各1分)(3)蒸发浓缩(1分)冷却结晶(1分)(4)ZnSO4+C12H22O14Ca=CaSO4↓+C12H22O14Zn(2分)降低葡萄糖酸锌的溶解度(2分)(5)该同学也能制得葡萄糖酸锌,但产品可能不纯(2分)(答产品不纯即可得分)19.(14分)(1)能(2分)(2)反应速率、平衡转化率、催化剂的活性(任写两点,2分)(3)8.33或25(2分)3+-++-(4)8H+N2+6e=2NH4(2分)(或答6H+N2+6e=2NH3)(5)①1.96%(2分)②高电压有利于竞争反应2H2eH2的进行,从而不利于产NH3(2分)(6)N2H2和N2H4(2分,对一个得1分,错写不多扣分)12023年湖北省八市高三(3月)联考化学参考答案1.C2.C3.C4.B5.D6.D7.B8.C9.B解析:A分子中含有8个手性碳原子10.B11.A12.B13.D+-14.D解析:A.H在阴极得电子生成H原子,H与Fe(III)反应生成Fe(II),Fe(II)还原NO3+-+生成Fe(III)和NH4,Cl在阳极失电子生成Cl2,Cl2与水反应生成HCl和HClO,NH4与HClO反应生成N2。.电极发生--+=++,电极发生+-++=++,Da4Cl−8e4H2O4HClO4HbNO38e10HNH43H2O再根据氧化+的离子方程式++=+-+++,根据分析HClONH42NH43HClON2↑3Cl5H3H2O生成的4molHClO中有1.5mol变为氯离子,还有2.5molHClO在溶液中,因此在处理过程中Cl-浓度不断减少15.D15解析A项:滴定的2次突变分别在酸性和碱性范围,应选择不同的指示剂,A项正确。B项:首先识别三条曲线①②③分别代表的微粒,然后看图说话,pH=8时,c(R2-)>c(HR-);+2-pH=8时,溶质为NaHR和Na2R,所以c(Na)>c(R),B项正确。2--C项:X点,δ(R)=δ(HR),pKa2=7.22,-Z点,δ(H2R)=δ(HR),pKa1=1.85,2-11Y点,δ(H2R)=δ(R),pH=(pKa1+pKa2)=(1.85+7.22)=4.54,22C项正确。2--7.22-2-c(H_x001F_2R)·c(R)Ka2102D项:根据2HRH2R+R==<1,即c(HR2--1.85c(HR)Ka110-2-)>c(R)·c(H2R),D项错误。16(13分)(1)圆底烧瓶(1分),b(1分)。2(2)防止温度过高,反应速率过快(2分)(答减速即可得分)(3)CrO3+2HCl=CrO2Cl2+H2O(2分)。(方程式不平不得分)(4)加入过量氯化钠可产生过量的氯化氢气体,使更多的CrO3参与反应。(2分)(5)减缓铬酰氯挥发(2分)(6)B(1分)吸收未参与反应的HCl气体和溢出的铬酰氯蒸气,防止空气中的水蒸气进入装置。(2分)(两条各1分未答吸收铬酰氯蒸气不扣分)【16解析】(1)由图可知A为圆底烧瓶。B中,冷凝水应下口进上口出。(2)A中反应为放热反应,在反应前冷却浓硫酸可防止反应速率过快,同时也可防止A中温度过高导致铬酰氯大量挥发。(3)已知反应物CrO3和HCl,还知道生成物含有中CrO2Cl2,写出反应物和生成物,配平即可得到反应:CrO3+2HCl=CrO2Cl2+H2O。(4)反应过程中有一部分氯化氢气体来不及与CrO3接触就逸出液面,导致CrO3反应不充分。加入过量氯化钠可产生过量的氯化氢气体,使更多的CrO3参与反应,增大了铬酰氯的产率。(5)常温下铬酰氯易挥发,铬酰氯蒸气仅凭冷凝管冷却,难以转化为液体,用冰水浴可将铬酰氯蒸气尽可能转化为液体,同时也可减少液态铬酰氯的挥发。(6)尾气中含氯化氢气体和铬酰氯蒸气,铬酰氯与水反应可生成盐酸和铬酸,氢氧化钠溶液可同时吸收氯化氢气体与铬酰氯蒸气。但铬酰氯易水解,不能将产物的收集装置直接连接到装有氢氧化钠溶液的吸收装置中。碱石灰中含有氢氧化钠固体,氢氧化钠固体易吸潮,其表面会吸收少量水分,氯化氢气体和铬酰氯蒸气通过吸潮后的氢氧化钠固体时可以被吸收。17(14分)(1)相同(2分)(2)19(2分)(3)(2分)(4)8(2分)(5)氨基(1分)碳氟键(1分)2HCl(1分)(6)①加成反应(1分)②形成的五元环较稳定(2分)(或答酰胺键比酯基稳定)17解析(1)A与SOCl2发生取代反应生成酰卤,得B,B与CH3-NH2发生取代反应生成酰胺,得化合物C,所以这两个反应的反应类型相同。3(2)具有酰胺类物质的性质,苯环上第3个取代基可以是:、、、、,所以满足C的同分异构体还有19种(5×4-1)。(3)联系C和F的结构,容易判断C与(D)发生取代反应生成化合物E()。(4)化合物F核磁共振氢谱的吸收峰有8组:(5)G可以由X转化得到:4(6)(五元环、六元环较稳定)18(14分)+2+(1)MnO2(或答二氧化锰)(2分)Mn2O3+2H=MnO2+Mn+H2O(2分)2+2+3+(2)将溶液中的Mn氧化为MnO2沉淀除去;将溶液中的Fe氧化为Fe。(2分,两条各1分)(3)蒸发浓缩(1分)冷却结晶(1分)(4)ZnSO4+C12H22O14Ca=CaSO4↓+C12H22O14Zn(2分)降低葡萄糖酸锌的溶解度(2分)(5)该同学也能制得葡萄糖酸锌,但产品可能不纯(2分)(答产品不纯即可得分)+2+【18解析】(1)由已知①可知,反应物为Mn2O3和H生成物含有MnO2和Mn,写出反应+2+物和生成物,配平后可得到反应:Mn2O3+2H=MnO2+Mn+H2O。因此,沉淀1为MnO2。(2)由已知②可知,Mn2+与Zn2+开始沉淀与完全沉淀的pH范围有部分重合的地方,难以2+2+通过调pH将Mn除去,因此,Mn在此处应被氧化成MnO2沉淀除去。另外,氧化过程还将溶液中的Fe2+氧化为Fe3+,并通过调节pH除去。(3)由于葡萄糖酸锌极易溶于热水,溶于冷水,溶解度有一定的差异,可蒸发浓缩、冷却结晶的操作分离提纯。(4)由于CaSO4微溶,可写出复分解反应:ZnSO4+C12H22O14Ca=CaSO4↓+C12H22O14Zn。因为葡萄糖酸锌在水中的溶解度较大,可推知其即使经过浓缩后也不易结晶,向溶液中加入少量乙醇后可降低葡萄糖酸锌的溶解度,使其顺利结晶。(5)能得到葡萄糖酸锌,因为Zn(OH)2与H2SO4反应生成ZnSO4,ZnSO4可与C12H22O14Ca反应生成C12H22O14Zn,并在乙醇作用下顺利结晶。19.(14分)(1)能(2分)(2)反应速率、平衡转化率、催化剂的活性(任写两点,2分)(3)8.33L2/mol2或25L2/mol2(2分)(单位不写不扣分)3+-++-(4)8H+N2+6e=2NH4(2分)(或答6H+N2+6e=2NH3)(5)①1.96%(2分)②高电压有利于竞争反应2H2eH2的进行,从而不利于产NH3(2分)5(6)N2H2和N2H4(2分,对一个得1分,错写不多扣分)【19解析】(1)△G=△H-T△S=-92400-298.15×(-200)<0,可以自发进行;(3)列三段式:222x3c(NH3)0.625,解得x=0.3mol/L,则22K33L/mol22x7c(N2)c(H2)0.20.63(5)最大产率,则此时氨气的生成速率最大,为0.68mg/min。0.68氨气的实际产量为0.04mmol/min,氨气的理论产量应以氮气100%转化为NH3进行1725mL/min100计算,即*2mmol/min。故此时氨气的产率为1.96%。24.5L/mol49(6)要求结构对称,根据机理图,可以得知为HN=NH和H2N-NH2。6
化学参考答案
你可能还喜欢
购买VIP会员享超值特权
VIP专享免费下载,付费文档最高省50%
免费下载
付费折扣
身份标识
文档工具
限时7.4元/月购买VIP