衡阳市八中2024届高三暑假检测答案题1234567891011121314号答BDBDDDBCADBBCA案1.B【解析】油脂不是高分子。2.D【解析】淀粉的分子式为CHO,A错误.铍原子最外层电子在s轨道上,电子(6105)n云轮廓图为球形,B错误.基态Fe2+的价电子排布式为3d6,故对应的价电子排布图应在3d轨道上排6个电子,C错误.+3.B【解析】AgNO溶液中滴加过量氨水,最终生成AgNH,A错误.用过3(3)2+2−−量氨水吸收SO2,由于氨水过量,得到NH4和SO3,无法得到HSO3,C错误.HS2为弱酸,离子方程式中不可拆写为S2−,D错误.4.D【解析】HO2分子稳定性与共价键强弱有关,与分子间氢键无关,A错+−误.NHO2H的水溶液显碱性与NH3类似,NH223OHH++ONHOHOH,−+3并非自身电离出OH,B错误.NHO2H与NH4中N均为sp杂化,中心N原子价层电+子对数为4,NH4中HNH−−键角为10928,但NHO2H中存在孤电子对,HNH−−键角小于10928,C错误,D正确.5.D【解析】反应①②③均断裂化学键吸收热量,ΔH0,A项正确;催化剂具有一定的选择性,使用恰当的催化剂,可调控反应进行的程度甚至停止,B项正确;根据A的稳定性大于B,物质越稳定所含能量越低,所以得到等质量的A和B时,生成B消耗的能量更多,C项正确;日光直射可能会爆炸,D项错误。6.D【解析】A.进行实验前必须进行的操作检验装置的气密性,一旦漏气实验失败,故A正确;B.氧气和硫化氢反应生成硫,H中出现浅黄色浑浊,可证明O非金属性强于S,故2+B正确;C.CuNH中存在N-H极性共价键和配位键,NH3中N原子价层电子对(3)41数为3+(5−31)=4,N原子的杂化类型为sp3杂化,故C正确;D.装置B与D中比2较,D中形成原电池后可以加快反应速率,则若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率小于D中速率,故D错误;7.【答案】B{#{QQABZYYEggCAAAAAARhCEQEiCkMQkBGAAKgOhEAIMAAByQFABAA=}#}【解析】【详解】A.与苯环直接相连的原子共面,醛基中原子共面,故A中所有原子可能共平面,A正确B.A发生氧化反应使高锰酸钾溶液褪色,和溴水发生取代反应使其褪色;B发生氧化反应使高锰酸钾溶液褪色,和溴水发生加成应、氧化反应使其褪色;C发生氧化反应使高锰酸钾溶液褪色,和溴水发生加成应、取代反应、氧化反应使其褪色;反应原理不相同,B错误;C.B含有醛基、醚键、碳碳双键,C含有醛基、酚羟基、碳碳双键;官能团数目相同,C正确;D.有机物A的同分异构体中含有苯环且能发生银镜反应的还有醛基羟基处于邻、间位,以及甲酸苯酚酯三种(不包含A),D正确;8.【答案】C【解析】【分析】X、Y、Z、W为核电荷数依次增大的前20号主族元素,且位于不同的周期,则它们分别为第一、二、三和四周期,而W可形成一价阳离子,为K元素,根据结构图,可推出X、Y、Z分别是H、O、P元素。【详解】A.该化合物含有K元素,焰色反应是紫色,A错误;B.非金属性O>N>P,故PH3的热稳定性比H2O的要差,B错误;C.O元素与其它三种元素可形成:H2O、H2O2;K2O2、KO2;P2O5、P4O10至少两种二元化合物,C正确;--2-+-D.KH2PO4溶液中,H2PO4既能电离也能水解,H2PO4HPO4+H,H2PO4+H2O-2-H3PO4+OH,溶液显酸性,电离程度大于水解程度,故c(HPO4)>c(H3PO4),故D错误。故选C。9.【答案】A【解析】【详解】A.二氧化硫、硫化钠、碳酸钠反应生成Na2S2O3同时生成二氧化碳,反应为222−−−4SO2SCO232+++32=3SOCO,A正确;B.硫代硫酸钠和稀盐酸反应生成硫单质沉淀、二氧化硫和氯化钠,取少量样品溶于水,先加入过量稀盐酸,再滴加BaCl2溶液,有沉淀生成,不能证明样品含有硫酸钠,B错{#{QQABZYYEggCAAAAAARhCEQEiCkMQkBGAAKgOhEAIMAAByQFABAA=}#}误;C.探究温度对硫代硫酸钠与硫酸反应速率的影响,应该首先加热至反应要求温度,然后2-+再将两种反应溶液混合,反应的离子方程式为SO23+2H=S↓+SO2↑+H2O,C错误;D.少量氯气和过量硫代硫酸钠反应生成硫酸根离子、氯离子、硫单质、二氧化硫气体,2-2--反应为6SO+4Cl=2SO+8Cl+2324+5S5SO2,D错误;故选A。10.【答案】D【解析】【详解】A.基态碳原子核外电子排布为1s22s22p2,核外存在2对自旋相反的电子,A错误4-22B.CS分子中C价层电子对数为2=2+,则中心原子为sp杂化,B错误;22C.一定条件下CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其晶体熔沸点较低,类型属于分子晶体,C错误;D.SiC的晶体结构与晶体硅相似,为共价晶体,则晶体中微粒间存在的作用力是共价键,D正确;故选D。11.【答案】B【解析】【详解】A.由题干可知,HT2为二元弱酸,在水溶液中的电离方程式为:+--+2-HTH+HT2、HTH+T,A错误;10−14-−−116B.常温下,HT的水解常数为Kh2==1.110K=4.310,则K10.01mol/LNaHT水溶液中电离大于水解,溶液显酸性,往水溶液中继续加水稀释,溶液中氢离子浓度减小,溶液的pH逐渐增大,B正确;C.0.01mol/LNa2T水溶液中由质子守恒可知:−+−c(OH)=c(H)+c(HT)+2c(H2T),C错误;{#{QQABZYYEggCAAAAAARhCEQEiCkMQkBGAAKgOhEAIMAAByQFABAA=}#}D.由题干提供电离常数可知,HC224O与过量的NaT2水溶液反应生成草酸根离子和-2−−2-HT,离子方程式:H2C2O4+2T=C2O4+2HT,D错误;故选B。12.【答案】B【解析】【分析】由图可知,放电时,镁失去电子发生氧化反应生成镁离子,故Mg电极为负极,则FeS为正极;【详解】A.由分析可知,电极为负极,A正确;B.镁、FeS均会和硫酸反应,故不能加硫酸,B错误;C.充电时,FeS为阳极,铁发生氧化反应生成FeS,阳极电极反应式为−+FeLiS2eFeS2Li+−=+2,C正确;D.充电时,阳极电极反应式为,阴极反应为MgMg2+−+2e=,则每转移1mol电子,生成1mol锂离子、消耗0.5mol镁离子,电解质溶液质量减少12g-7g=5g,D正确;故选B。13.【答案】C【解析】−1详解】A.Ⅰ、CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.2kJmol,Ⅱ、−1CH4222(g)+=+=2HO(g)CO+(g)4H(g)ΔH165kJmol,根据盖斯定律,由Ⅰ2-−1Ⅱ得到CH422(g)+=+=CO+(g)2CO(g)2H(g)ΔH247.4kJmol,选项A正确;B.过程Ⅱ的反应第一步是CO+CO2+H2+Fe3O4+CaO→H2O+Fe+CaCO3,第二步反应:Fe+CaCO3+稀有气体→稀有气体+Fe+CaCO3+CO,两步反应实现了含碳物质与含氢物质的分离,选项B正确;【.过程中、为催化剂,改变反应速率不能改变反应的,选项不正CⅡFe34OCaOHC确;D.根据流程中物质的参与和生成情况,结合反应过程中有催化剂和中间产物,总反应可{#{QQABZYYEggCAAAAAARhCEQEiCkMQkBGAAKgOhEAIMAAByQFABAA=}#}表示为CH3CO4CO2HO42+=+2,选项D正确;答案选C。14.【答案】A【解析】【分析】海绵铜加入硫酸和硝酸铵溶解得到的溶液主要是硫酸铜,硫酸铵等,加入亚硫酸铵还原硫酸铜、在氯化铵环境中发生反应生成氯化亚铜沉淀、硫酸铵和硫酸,过滤得到氯化亚铜沉淀、用稀硫酸洗涤,最终得到氯化亚铜;【详解】A.空气中氧气具有氧化性,酸性条件下也能将铜氧化为铜离子,故“溶解”时,通入空气可以减少大气污染,A正确;B.“还原”时,铜离子、亚硫酸根离子、氯离子反应生成氯化亚铜沉淀、硫酸根离子,反2+2-2+−−应的离子方程式为:2Cu+SO+H324O+2Cl=2CuCl+SO+2H,B错误;C.“过滤”时,玻璃棒搅拌液体有可能捣破滤纸,故过滤时不可以搅拌,C错误;D.氯化亚铜微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿空气中易水解氧化,则“酸洗”时不能用盐酸、不能用硝酸(防止被氧化),最适宜选用的是稀硫酸,还可循环利用,D错误;故选A。15.【答案】(1)分水器中液体不分层(2)趁热过滤,洗涤,干燥(3)CCl4密度比水大,会在分水器的下层,水在上层2-+(4)96%(5)①.SO+2H=H322O+SOa②.淀粉溶液③.0.1344【解析】【分析】通过蒸馏得到无水醋酸铅,再利用滴定法测定其溶液中含有的亚硫酸盐的含量。【小问1详解】互不相溶的水和甲苯在加热过程中形成共沸物进入分水器,水的密度比甲苯大,在分水器的下层,甲苯在.上层,打开分水器下部的活塞可将水从下部接收,当分水器中液体不分层时,则脱水完成,可以停止加热;【小问2详解】停止加热,烧瓶底部由大量白色醋酸铅粉末状固体析出,进一步得到醋酸铅的操作为:趁{#{QQABZYYEggCAAAAAARhCEQEiCkMQkBGAAKgOhEAIMAAByQFABAA=}#}热过滤,洗涤,干燥;【小问3详解】用CCl4不行,因为CCl4密度比水大,会在分水器的下层,水在上层,导致液体超过分水器支管口后水又重新流入二颈瓶中,达不到脱水的目的;答案为CCl4密度比水大,会在分水器的下层,水在上层;【小问4详解】根据反应可得关系式:(CHCOO)Pb3HO~(CHCOO)Pb32337932537.9gxg31.2g?列比例式可得出,x=32.5,故醋酸铅的产率=100%=96%;32.5g【小问5详解】2-+a.辣椒粉样品酸化时发生的离子方程式为SO+2H=H322O+SO;+b.滴定的原理为SOI+2H=H2224+SO+2HI,选用淀粉做指示剂,当滴入最后半滴,锥形瓶的溶液中出现蓝色,且半分钏不褪色,即达到滴定终点,操作中选择的指示剂为淀粉溶液;c.根据滴定原理消耗2.10mL0.01mol/L的I2溶液,则辣椒粉中残留亚硫酸盐的含量为0.012.1010−364=0.1334g/kg。1010−316.【答案】(1)NH3(氨水或液氨)(2)6NH3+H2SiF6+2H2O=6NH4F+SiO2,+−2+(3)5AsF3+10HF+6H+2MnO4=2Mn+5ASF5+8H2O-−(4)当HF浓度大于5.0mol/L时,HF与F形成氢键,形成HF2,促进了HF的电离;4M3(5)①.8②.3g/cmNaA【解析】【分析】该题涉及到两个工艺流程过程,在第一个中.以氟硅酸(H2SiF6)制备氟化钙,在第二个中用氟化钙与浓硫酸反应可以制取HF,同时本题还考查了晶胞的相关计算以及价层电子{#{QQABZYYEggCAAAAAARhCEQEiCkMQkBGAAKgOhEAIMAAByQFABAA=}#}对互斥理论。【小问1详解】从工艺流程分析在化学预处理NH3和H2SiF6反应制得NH4F,利用制得的NH4F和石灰石反应制得HF和NH3,因此可以循环利用的物质是NH3(氨水或液氨);【小问2详解】据I的工艺流程分析,通过化学预处理中NH3和H2SiF6反应制得NH4F,因此聚四氟乙烯反应釜中发生反应的化学方程式为:6NH3+H2SiF6+2H2O=6NH4F+SiO2;【小问3详解】精制HF过程中,用高锰酸钾溶液进行化学预处理,将AsF3氧化,氧化得到的物质AsF5,+−2+其化学处理的离子方程式为:5AsF3+10HF+6H+2MnO4=2Mn+5ASF5+8H2O;【小问4详解】当HF浓
湖南省衡阳市第八中学2023-2024学年高三上学期开学考试 化学答案
你可能还喜欢
购买VIP会员享超值特权
VIP专享免费下载,付费文档最高省50%
免费下载
付费折扣
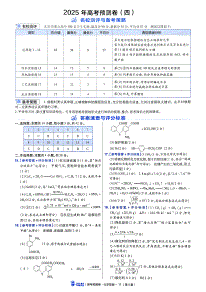
身份标识
文档工具
限时7.4元/月购买VIP
相关推荐
-
湖南省衡阳市第八中学2023-2024学年高三上学期开学考试 物理
2023-11-24 09:54
 3页
3页 -
湖南省衡阳市第八中学2023-2024学年高三上学期开学考试 语文
2023-11-24 09:54
 5页
5页 -
湖南省衡阳市第八中学2023-2024学年高三上学期开学考试 数学
2023-11-24 09:54
 7页
7页 -
湖南省衡阳市第八中学2023-2024学年高三上学期开学考试 物理答案
2023-11-24 09:54
 5页
5页 -
江苏省南通市如皋市2024届高三上学期期初考试押题卷试题解析
2023-11-24 09:55
 11页
11页 -
江苏省南通市如皋市2024届上学期期初考试押题卷语文学科
2023-11-24 09:55
 11页
11页 -
江苏省南通市如皋市2024届上学期期初考试押题卷政治学科
2023-11-24 09:55
 7页
7页 -
江苏省南通市如皋市2024届高三上学期期初考试押题卷化学试题(解析版)
2023-11-24 09:55
 21页
21页