公众号:高中试卷君机密★启用前2024年3月高三调研考试试卷化学(长沙县、望城区、浏阳市、宁乡市联合命制)注意事项:1.本试卷共8页,18小题,满分100分,考试时间75分钟.2.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上.3.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其他答案标号.回答非选择题时,将答案写在答题卡上,写在本试卷上无效.4.考试结束后,将本试题卷和答题卡一并交回.5.可能用到的相对原子质量:H~1;C~12;N~14;O~16;F~19;Na~23;Si~28;K~39;Mn~55;Ni~59;Cu~64一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求.1.化学与生活、生产及科技密切相关。下列说法正确的是A.华为自主研发的“麒麟”芯片与太阳能电池感光板所用的主要材料均为晶体硅B.卡塔尔世界杯球馆屋顶采用折叠式PTFE(聚四氟乙烯)板材,属于天然高分子材料C.“神舟十七号”发动机的耐高温结构材料Si3N4属于分子晶体D.14C可用于文物年代的鉴定,14C与12C互为同素异形体2.下列化学用语描述正确的是A.Cl-的原子结构示意图B.NH3的电子式C.HO2的VSEPR模型D.基态F原子的价层电子轨道表示式第1页/共11页学科网(北京)股份有限公司公众号:高中试卷君3.设NA为阿伏加德罗常数的值.下列说法正确的是A.0.1molNa2O2固体与足量的H2O充分反应,转移0.2NA个电子2+23B.1mol[Cu(NH3)4]中含有σ键的数目约为16´6.02´102-C.1L0.1mol/LK2Cr2O7酸性溶液中所含Cr2O7的数目为0.1NA-D.0.05mol/L的BaCl2溶液中含有Cl的数目为0.1NA4.下列离子方程式书写正确的是--2A.向次氯酸钠溶液中通入少量CO2:2ClO+CO2+H2O=2HClO+CO3--+2-B.将少量氯气通入NaHSO3溶液中:HSO3+H2O+Cl2=2Cl+3H+SO4通电2++C.用铜作电极电解硫酸铜溶液:2Cu+2H2O2Cu+O2+4H2+2-+-D.向NaHSO4溶液中滴加少量的Ba(OH)2溶液:Ba+SO4+2H+2OH=2H2O+BaSO4¯5.根据下列实验操作和现象所得到的结论正确的是选实验操作现象结论项向盛有等体积、等浓度的HO22溶液的两支试管加KMnO4溶液-2+MnO4比Cu的催化效A中分别加入0.2mL等浓度CuSO4溶液和的试管中产生气果好泡速率更快KMnO4溶液向盛有2mL0.1mol×L-1AgNO溶液的试管中滴3先有白色沉淀生-1B加1mL0.1mol×LNaCl溶液,再向其中滴加成,后又产生黄Ksp(AgCl)>Ksp(AgI)色沉淀4~5滴0.1mol×L-1KI溶液.-C向苯酚浊液中滴加少量Na2CO3溶液浊液变澄清酸性:苯酚>HCO3向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸颜色无明显+D原溶液中无NH4试纸置于试管口变化第2页/共11页学科网(北京)股份有限公司公众号:高中试卷君A.AB.BC.CD.D6.M是一种具有优良光学性能的树脂,其结构如图所示.下列说法错误的是A.分子中仅含有一种含氧官能团B.分子中所有碳原子可能共平面C.与足量H2加成后的产物中只含有2个手性碳原子D.1molM最多可与5molNaOH发生反应7.X、Y、Z为短周期主族元素,化合物ZYX2是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体ZY2。下列说法正确的是A.电负性:Z
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试化学试卷(原卷版)
你可能还喜欢
购买VIP会员享超值特权
VIP专享免费下载,付费文档最高省50%
免费下载
付费折扣
身份标识
文档工具
限时7.4元/月购买VIP
相关推荐
-
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试生物试题(原卷版)
2024-03-19 19:31
 10页
10页 -
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试化学试卷(解析版)
2024-03-19 19:31
 23页
23页 -
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试生物试题(解析版)
2024-03-19 19:31
 22页
22页 -
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试数学答案
2024-03-19 19:31
 11页
11页 -
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试地理试题
2024-03-19 19:31
 7页
7页 -
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试物理试卷(无答案)
2024-03-19 19:31
 7页
7页 -
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试物理试卷答案
2024-03-19 19:31
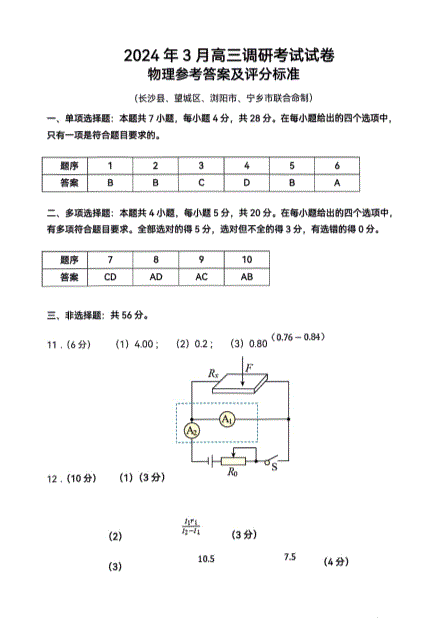 6页
6页 -
湖南省长沙市长沙县、望城区、浏阳市、宁乡市2024届高三下学期3月调研考试英语试题卷(无答案)
2024-03-19 19:31
 9页
9页