2024届新高三开学摸底考试卷(江西、安徽、贵州、广西、黑龙江、吉林、甘肃七省通用)化学(考试时间:75分钟试卷满分:100分)注意事项:1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。3.考试结束后,将本试卷和答题卡一并交回。可能用到的相对原子质量:H1C12N14O16Cu64Zn65第Ⅰ卷(选择题共42分)一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.化学与生产、生活、科技及环境等密切相关下列说法正确的是A.“天和”核心舱用到的镁合金涂层中的自愈缓蚀剂2-巯基苯并噻唑(C7H5NS2)属于有机高分子化合物B.植物可以吸收利用空气中的NOx作为肥料,实现氮的固定C.葡萄酒中通常添加有微量SO2,既可以杀菌又可以防止营养成分被氧化D.我国新一代长征七号运载火箭使用的是液氧煤油发动机,煤油主要由煤的干馏制得【答案】C【详解】A.2-巯基苯并噻唑(C7H5NS2)不是聚合物,不属于有机高分子化合物,故A错误;B.植物可以吸收利用空气中的NOx作为肥料,该过程是含N化合物之间的转化,不属于氮的固定,故B错误;C.二氧化硫与水作用生成亚硫酸,亚硫酸能夺取菌体细胞中的氧,菌体细胞因脱氧至死,从而起到杀菌消毒的作用,同时其还原性也可以防止营养物质被氧化,微量SO2可以添加至葡萄糖中杀菌并防止营养成分被氧化,故C正确;D.煤油是轻质石油产品的一类,由天然石油或人造石油经分馏或裂化而得,故D错误;故选C。2.下列化学用语或图示表达不正确的是A.的模型: B.羟基的电子式:C.的结构示意图: D.原子核内有8个中子的碳原子:【答案】A【详解】A.中心S原子的价层电子对数为,不含孤对电子,模型为平面三角形,故A错误;B.羟基是电中性微粒,电子式为:,故B正确;C.S为16号元素,核外电子排布为2,8,8,离子结构示意图为,故C正确;D.8个中子的碳原子,质量数为14,核素表示式为:,故D正确;故选:A。3.燃油汽车行驶中会产生CO、NO等多种污染物。下图为汽车发动机及催化转化器中发生的部分化学反应。以下判断错误的是A.甲是空气中体积分数最大的成分 B.乙是引起温室效应的气体之一C.反应(Ⅰ)在常温下容易发生 D.反应(Ⅱ)中NO是氧化剂【答案】C【分析】甲和氧气反应生成一氧化氮,一氧化氮和一氧化碳反应生成甲和二氧化碳,再根据元素守恒,则甲为氮气。【详解】A.甲是氮气,氮气空气中体积分数最大的成分,故A正确;B.乙是二氧化碳,则乙是引起温室效应的气体之一,故B正确;C.由于氮气含有氮氮三键,因此反应(Ⅰ)在常温下不容易发生,在高温或放电条件下发生,故C错误;D.一氧化碳和一氧化氮反应生成氮气和二氧化碳,一氧化氮中氮化合价降低,因此反应(Ⅱ)中NO是氧化剂,故D正确。综上所述,答案为C。4.藿香蓟具有清热解毒功效,其有效成分结构如下。下列有关该物质的说法错误的是 A.可以发生水解反应 B.所有碳原子处于同一平面C.含有2种含氧官能团 D.能与溴水发生加成反应【答案】B【详解】A.藿香蓟的分子结构中含有酯基,因此其可以发生水解反应,A说法正确;B.藿香蓟的分子结构中的右侧有一个饱和碳原子连接着两个甲基,类比甲烷分子的空间构型可知,藿香蓟分子中所有碳原子不可能处于同一平面,B说法错误;C.藿香蓟的分子结构中含有酯基和醚键,因此其含有2种含氧官能团,C说法正确;D.藿香蓟的分子结构中含有碳碳双键,因此,其能与溴水发生加成反应,D说法正确;综上所述,本题选B。5.下列关于第ⅣA族元素及其化合物的性质比较中,不正确的是A.原子半径:CSiH4>GeH4,C项正确;D.酸性CH3COOH>H2CO3>H2SiO3,D项正确。答案选B。6.NA是阿伏加德罗常数的值。下列说法正确的是A.22.4L(标准状况)氮气中含有7NA个中子B.1mol重水比1mol水多NA个质子C.12g石墨烯和12g金刚石均含有NA个碳原子D.1L1mol·L−1NaCl溶液含有28NA个电子【答案】C【详解】A.标准状况下22.4L氮气的物质的量为1mol,若该氮气分子中的氮原子全部为14N,则每个N2分子含有(14-7)×2=14个中子,1mol该氮气含有14NA个中子,不是7NA,且构成该氮气的氮原子种类并不确定,故A错误;B.重水分子和水分子都是两个氢原子和一个氧原子构成的,所含质子数相同,故B错误;C.石墨烯和金刚石均为碳单质,12g石墨烯和12g金刚石均相当于12g碳原子,即=1molC原子,所含碳原子数目为NA个,故C正确;D.1molNaCl中含有28NA个电子,但该溶液中除NaCl外,水分子中也含有电子,故D错误;故答案为C。7.实验室制备下列气体所选试剂、制备装置及收集方法均正确的是 �气体�试剂�制备装置�收集方法��A��浓�①�⑥��B���②�⑤��C���②�④��D��浓�③�⑥��A.A B.B C.C D.D【答案】D【详解】A.二氧化氮与水反应,不能选⑥收集二氧化氮,A项错误;B.过氧化氢和二氧化锰反应制取氧气,不需要加热,不能选②制备氧气,B项错误;C.加热氯化铵分解生成氨气和氯化氢,在试管口氨气与氯化氢化合生成氯化铵,不能制备氨气,C项错误;D.乙醇在170℃时发生消去反应生成乙烯,可选③装置,乙烯不溶于水,可选⑥装置收集,D项正确;答案选D。8.某平面形分子常用于感光复印纸的生产,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,且仅X、Y位于同一周期;Z原子的核外电子数是其次外层电子数的2倍。下列说法正确的是A.原子半径: B.元素的含氧酸是强酸C.该分子中、原子的杂化类型均为 D.、、形成的化合物不会含有离子键【答案】C【分析】短周期主族元素Z原子的核外电子数是其次外层电子数的2倍,可推知Z是S,由平面形分子的结构可知X可形成4个共价键,Y可以形成3个共价键,且仅X、Y位于同一周期,可知X为C,Y为N,又因W、X、Y、Z为原子序数依次增大,且属于另一个周期,所以W为H。【详解】A.根据原子在元素周期表中的位置可知,原子半径:,即,故A错误;B.元素是S,它有多种含氧酸,只有最高价含氧酸是强酸,故B错误;C.由结构图和平面形分子可知、原子的杂化类型均为 ,故C正确;D.、、可形成的化合物可以是硫酸铵或硫酸氢铵,是铵盐,会含有离子键,故D错误;故答案为:C。9.下列解释实验现象或用途的离子方程式书写不正确的是A.用硫化钠处理含汞废水:B.将通入氢氧化钠溶液中制消毒液:C.溶液腐蚀铜板:D.溶于稀盐酸:【答案】D【详解】A.硫化钠和汞离子生成硫化汞,故离子方程式为,故A正确;B.氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为,故B正确;C.氯化铁和铜反应生成氯化铜和氯化亚铁,离子方程式为,故C正确;D.碳酸钙为难溶盐,不能拆开写,故离子方程式为,故D错误;故选D。10.表述I和II均正确但不具有因果关系的是选项�表述I�表述II��A�用熟石灰处理酸性废水�熟石灰中含有��B�可与反应产生�氧化性:��C�石油裂解气能使溴的溶液褪色�石油裂解可得到乙烯等不饱和烃��D�过饱和醋酸钠溶液会产生结晶现象�饱和醋酸钠溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出��A.A B.B C.C D.D【答案】A【详解】A.因为熟石灰显碱性,可用熟石灰处理酸性废水,A错误;B.因为氧化性:,可与反应产生,发生反应:,B正确;C.因为石油裂解可得到乙烯等不饱和烃,所以石油裂解气能与溴发生加成反应,使溴的溶液褪色,C正确;D.因为饱和醋酸钠溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出,所以过饱和醋酸钠溶液会产生结晶现象,D正确;故选A。11.下列说法正确的是A.过量粉分别与、反应均能得到+2价铁的化合物B.与溶液反应制可在较高温度下进行C.淀粉与纤维素水解的最终产物都是葡萄糖D.、分别与反应的产物完全相同【答案】C【详解】A.氧化性比S强,过量粉分别与、反应分别得到FeCl3和FeS,故A错误;B.为了避免副反应的发生,与溶液反应制需要在低温下进行,故B错误;C.淀粉和纤维素在催化剂和加热条件下水解的最终产物都是葡萄糖,故C正确;D.、分别与反应的方程式为、,故D错误;故答案为:C 。12.在催化剂作用下,向容积为1L的容器中加入1molX和3molY,发生反应:,平衡时和反应10min时X的转化率(X)随温度的变化分别如曲线I、Ⅱ所示。下列说法错误的是A.该反应B.200℃时,前10min的平均反应速率C.400℃时,反应的平衡常数K=2D.bc段变化可能是催化剂在温度高于400℃时活性降低导致【答案】C【详解】A.升高温度,转化率增大,平衡正向移动,正向是吸热反应即该反应,故A正确;B.200℃时,前10min的平均反应速率,故B正确;C.400℃时,X转化率为60%,反应的平衡常数,故C错误;D.ab阶段随温度升高,转化率增大,bc阶段随温度升高,转化率减小,该变化可能是催化剂在温度高于400℃时活性降低导致,故D正确。综上所述,答案为:C。13.近期,科学家研发了“全氧电池”,其工作原理示意图如下。下列说法不正确的是A.电极a是负极B.电极b的反应式:C.该装置可将酸和碱的化学能转化为电能D.酸性条件下的氧化性强于碱性条件下的氧化性【答案】B【分析】该电池a的电极反应为:,a为负极,b的电极反应为:,为原电池的正极。【详解】A.a的电极反应为:,a为负极,A正确;B.b的电极反应为:,为原电池的正极,B错误;C.该反应的总反应式为:,可将酸和碱的化学能转化为电能,C正确;D.酸性条件下发生反应,碱性条件下发生反应,所以酸性条件下的氧化性强于碱性条件下的氧化性,D正确;故选B。14.室温下,将溶液与过量固体混合,溶液随时间变化如图所示。已知: 下列说法不正确的是A.两者混合发生反应:B.随着反应的进行,逆向移动,溶液下降C.充分反应后上层清液中约为D.内上层清液中存在:【答案】D【详解】A.微溶于水,难溶于水,溶液与过量固体混合反应生成,离子反应为:,故A正确;B.随上述反应的进行,减小,使得逆向移动,c()减小,pH减小,故B正确;C.充分反应后上层清液为碳酸钙和硫酸钙的饱和溶液,≈,故C正确;D.根据电荷守恒得:,溶液呈碱性,,则,故D错误;故选:D。第II卷(非选择题共58分)二、非选择题:本题共4个小题,共58分。15.(14分)某湿法炼锌的萃余液中含有及二价钴离子()、镍离子()、镉离子()和等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图: 已知:沉淀物����������������(1)“氧化、调”时,先加入适量的石灰石调节pH为1.0,加入适量的,再加入石灰石为4.0,①“沉渣”的主要成分除外还有_______。②若加入过量的,钴元素会被氧化进入“沉渣”中,则溶液中残留的浓度为____。(2)“沉锌”时,在近中性条件下加入可得碱式碳酸锌固体,同时产生大量的气体,试分析产生大量气体的原因是_____________________________。(3)由碱式碳酸锌生成氧化锌的化学方程式为______________________________。(4)沉锌后的滤液经过一系列操作后得到的副产品为________________________(填化学式)。(5)的晶胞结构如图,则锌的配位数为___________;已知晶胞参数为acm,
 10页
10页 11页
11页 19页
19页 8页
8页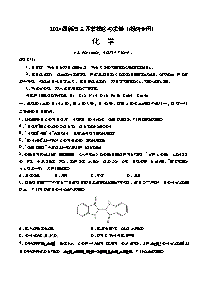 10页
10页 21页
21页 18页
18页 11页
11页












